¿Puedo elegir qué vacuna ponerme?
De las tres vacunas contra la COVID-19 aprobadas en España, ¿cuál recibiré? La decisión dependerá de factores como su conservación, el número de dosis, el coste o la emergencia, entre otros

Una enfermera prepara una vacuna de COVID-19 / GOVERN D'ANDORRA (EUROPA PRESS)

Elche
La aparición de las vacunas en el escenario pandémico en que nos encontramos ha devuelto parte del optimismo perdido durante este último año. No obstante, al mismo tiempo, han surgido otros importantes retos que parecen ensombrecer el horizonte, relacionados, entre otros, con la priorización de los grupos poblacionales a vacunar, la logística de vacunación o la disponibilidad de las vacunas.
Más información
Asimismo, la existencia de diferentes vacunas ha sembrado dudas entre la población relacionadas principalmente con su eficacia y seguridad y con el proceso seguido para su autorización. Todo esto conlleva que queramos saber qué vacunas hay, cuál recibiremos y qué factores van a influir en esta decisión.
Proceso de autorización de las vacunas contra la COVID-19
Por razones de emergencia de salud pública, la Comisión Europea (CE) desarrolló una estrategia para favorecer la fabricación y distribución de vacunas frente a la COVID-19.
Esto ha supuesto un esfuerzo a nivel mundial sin precedentes para lograr una vacuna eficaz y segura en tiempo récord. Conviene señalar que la flexibilización del proceso de autorización no ha limitado el estudio de su eficacia y seguridad. Es decir, todas las vacunas autorizadas por la CE han seguido un camino similar en su evaluación.
Las estrategias para reducir los tiempos se han centrado en:
- Autorización por procedimiento centralizado. Implica una única evaluación europea y autorización de comercialización válida en toda la UE.
- Herramienta “rolling review”. Es decir, los datos de eficacia, seguridad y calidad se van evaluando conforme se van generando.
- Inversión en la logística necesaria para la producción a gran escala de la vacuna para garantizar un acceso equitativo a la misma.
- Autorización de comercialización condicional. Este es un instrumento contemplado en la legislación europea para agilizar la autorización de comercialización en emergencias sanitarias y ante necesidades médicas no cubiertas. Se da cuando el beneficio para la salud pública es superior a la incertidumbre de la limitación de los datos disponibles.
- Así, la Agencia Europea del Medicamento (EMEA) emitió una recomendación para que la Comisión Europea (CE) otorgara autorización de comercialización condicional para las vacunas de BioNTech/Pfizer y Moderna, y recientemente para la de Oxford-Astra Zeneca.
- Farmacovigilancia. Es un estrecho sistema de vigilancia posterior a la comercialización de vacunas. Se exige a la industria a seguir aportando datos de ensayos clínicos en marcha.
¿Entre qué vacunas podríamos elegir?
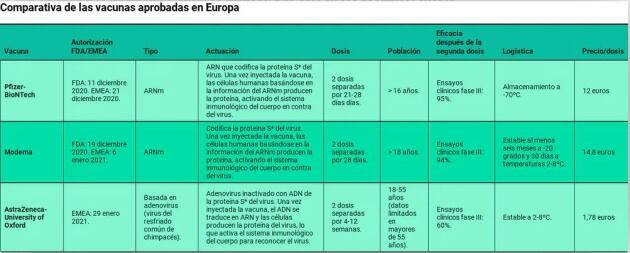
A día de hoy existen varias vacunas ya autorizadas o en evaluación y/o autorización. La de Pfizer-BioNTech y Moderna ya fueron autorizadas y se están administrando en España.
La vacuna de Oxford-AstraZeneca acaba de ser autorizada en Europa. Asimismo, otras vacunas, como la de Janssen/Johnson & Johnson, Sanofi/Pasteur/Glaxo Wellcome, CureVac y Novavax, cuya negociación está en curso, no han solicitado todavía autorización por la CE pero ya han firmado contrato de comercialización.
Paralelamente, hay más de 150 candidatas a vacuna frente al COVID-19 y alrededor de una de cada tres ha iniciado ensayos clínicos. Por eso, en los próximos meses veremos ampliado el abanico de vacunas disponibles.

Comparativa de las vacunas / THE CONVERSATION
Comparativa de las vacunas / THE CONVERSATION
Asumiendo las similitudes y diferencias de las distintas vacunas, lo importante es que todas ellas son seguras y poseen eficacia suficiente, por lo que el recibir una u otra es un aspecto menos relevante para la población.
¿Podemos elegir qué vacuna ponernos?
Como ya hemos visto, al tiempo que se desarrollan los ensayos clínicos, se ha avanzado en la fabricación de la vacuna, dada la necesidad mundial de dosis. El abastecimiento está siendo complejo, sin embargo. Hasta la fecha, el desarrollo de la campaña de vacunación está teniendo problemas logísticos importantes relacionados con el suministro de vacunas por parte de las compañías farmacéuticas, el almacenamiento y transporte, y con la capacidad del personal sanitario, dedicado a tiempo completo al cuidado de pacientes covid-19.
De acuerdo a los datos facilitados), en España se han administrado a 1 de febrero 3,44 dosis/100 personas. Es una cifra similar al resto de los países de la Unión Europea pero inferior a las cifras de Reino Unido, EE. UU. o Israel, que casi alcanza ya las 60 dosis por cada 100 personas.
Cada país ha establecido distintos mecanismos para cumplir el objetivo de vacunación masiva de la población. En el caso de Reino Unido o EEUU, el proceso de vacunación se inició una semana antes que en Europa y con menos problemas de suministro.
En estos países, además, se ha incluido a las farmacias y otros agentes sanitarios como centros de vacunación comunitarios, lo que ha permitido acelerar el proceso.
En España, la vacunación se está focalizando en la red sanitaria pública. Los farmacéuticos comunitarios se han ofrecido a contribuir a la red sanitaria de vacunación como recurso sanitario empleado en otros países del entorno. Teniendo en cuenta que en España existe una red de más 22 000 farmacias, la accesibilidad de estos profesionales sanitarios podría ser clave para optimizar el proceso de vacunación masiva necesario en estos tiempos de pandemia.
Considerando la complejidad del proceso de vacunación, no tiene sentido que cada persona elija qué vacuna ponerse. Además, se desconoce la disponibilidad potencial que tendrá cada vacuna en cada una de las fases de población prioritaria establecidas.
Tampoco sabemos qué vacunas estarán autorizadas por la CE, por lo que se vacunará a la población con aquellas vacunas que estén disponibles en cada momento.
No obstante, cuando haya suficiente disponibilidad (a medio o largo plazo), las autoridades sanitarias serán las encargadas de determinar la vacuna más apropiada para cada grupo de población.
Por ejemplo, en España es la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS) el órgano que adopta las decisiones acerca de cada proceso de vacunación. Esta monitoriza el desarrollo de las vacunas y garantiza la buena gobernanza y transparencia del proceso de adquisición y distribución.
Factores que influirán en la decisión
Teniendo en cuenta las diferencias entre las vacunas existentes, las autoridades podrán tener en cuenta los siguientes factores:
- En primer lugar, las características de conservación. En zonas donde pueda comprometerse la conservación, por ejemplo, en zonas rurales, se podrá dar prioridad a aquellas vacunas con un mantenimiento más sencillo.
- Es el caso de las vacunas de Pfizer-BioNTech y Moderna (y muchas otras que se encuentran en fase de desarrollo), que se basan en Ácido Ribonucleico mensajero (ARNm) monocatenario. Tienen una gran eficacia, pero su principal desventaja es la inestabilidad del ARNm. Esto condiciona su almacenamiento y complica la logística relacionada con la vacunación.
- Así, la vacuna de Pfizer-BioNTech debe almacenarse a -70ºC, necesitando contenedores especiales para su mantenimiento, y la vacuna de Moderna se mantiene estable durante 30 días entre 2 y 8 grados, y al menos 6 meses a -20ºC.
- Por su parte, la vacuna de AstraZeneca-Universidad de Oxford utiliza otra tecnología más tradicional, basada en la modificación genética de un virus del resfriado común, con la ventaja de que se mantiene estable entre 2 y 8 grados y se puede distribuir utilizando los canales ya existentes para otras vacunas.
- En segundo lugar, es importante tener en cuenta el número de dosis que exige cada vacuna. Las de una sola dosis (como la de Jansen/Johnson & Johnson) serían idóneas para población con dificultades de acceso al sistema sanitario. Por ejemplo, en países en vía de desarrollo donde la población muchas veces vive alejada de los centros sanitarios y se podría dificultar el acceso a la segunda dosis.
- Por otro lado, las compañías farmacéuticas deben realizar un seguimiento de la efectividad y seguridad de las vacunas. Asimismo, deberán seguir aportando los datos de los ensayos clínicos que tienen en marcha.
Por su parte, desde las autoridades sanitarias, el Sistema Español de Farmacovigilancia (coordinado por la AEMPS) ha desarrollado un Plan específico de la vigilancia de seguridad de las vacunas covid-19 y participa también junto con 7 países europeos en estudios de farmacovigilancia, el llamado proyecto ACCESS.
La adquisición de nuevos datos permitirá tomar medidas acerca de qué vacunas son eficaces y seguras en determinados grupos poblacionales que no se han evaluado hasta ahora.
En el caso de la vacuna de AstraZeneca-Oxford, por ejemplo, la mayor parte de los participantes en sus estudios clínicos tenían entre 18 y 55 años, por lo que se espera obtener más información acerca del uso de la vacuna en mayores a partir de los estudios que se están realizando.
También faltan datos de la utilización de las vacunas en otras poblaciones, como los niños o las mujeres embarazadas. Conforme vayan avanzando los estudios, se podrá saber qué vacuna es más favorable para su uso en estos otros grupos.
- El coste también es un factor importante que interviene en las decisiones. El precio de cada dosis es diferente. Aunque en situaciones de emergencia como la que estamos viviendo, no es un factor a tener en cuenta, sí que podrá ser un aspecto relevante cuando se normalicen las campañas de vacunación.
Por último, es importante aceptar que el control de la pandemia no se va a conseguir exclusivamente con la vacuna. Es necesario, tal y como ha explicado el virólogo Ian Mckay con el modelo de queso suizo, seguir manteniendo las medidas de prevención universales que llevamos realizando hasta ahora (limpieza de manos, mascarilla, distancia física).
También es imprescindible fortalecer los sistemas sanitarios de atención directa al enfermo y de salud pública (rastreo de contactos, aislamiento, cuarentena) y mejorar los determinantes sociales dirigidos a disminuir las diferencias socioeconómicas en la población, entre otras muchas.
Blanca Lumbreras Lacarra, Catedrática de Universidad. Área de Medicina preventiva y Salud Pública., Universidad Miguel Hernández y Elsa López-Pintor, Dra. en Farmacia, docente e investigadora en Farmacia Asistencial. Facultad de Farmacia. Universidad Miguel Hernández de Elche., Universidad Miguel Hernández
Este artículo fue publicado originalmente en The Conversation. Lea el original.





